Wie aus der Gesundheits-App eine vermarktbare digitale Gesundheitsanwendung (DiGA) wird – Teil 3
Veröffentlicht am 30th März 2021
„App auf Rezept“: Kommerzialisierung der DiGA
Nachdem wir uns in den vorhergehenden Beiträgen bereits mit digitalen Gesundheitsanwendungen und deren regulatorischen Rahmenbedingungen, ihren Möglichkeiten und Chancen beschäftigt haben, befasst sich der dritte Teil unserer vierteiligen Beitragsserie mit der Frage, wie man die digitale Gesundheitsanwendung (DiGA) kommerzialisiert und vermarktet.
Die Antwort ist einfach und in gewisser Weise auch bahnbrechend zugleich: Durch Verordnung der App durch den Arzt beziehungsweise Psychotherapeuten im Rahmen der Behandlung. Eine Verhandlung mit einzelnen Krankenkassen, wie vorher z.B. im Rahmen der Verhandlung von Verträgen zur besonderen Versorgung, ist damit nicht mehr erforderlich, um seine Gesundheitsanwendung im System der gesetzlichen Krankenversicherung anzubieten und zu kommerzialisieren. Ganz korrekt, ist die vorherige Antwort allerdings noch nicht die Verordnung der DiGA allein reicht noch nicht aus, um die Vergütung des Anbieters der Gesundheitsanwendung auszulösen, denn dafür ist auch noch eine Nutzung beziehungsweise eine Freischaltung der DiGa-App durch den Patienten erforderlich.
Der Anbieter einer DiGA muss sich daher bei der Verwertung nicht nur mit der Frage beschäftigen, wie er die ärztliche Verordnung seiner DiGA fördern kann, sondern auch, wie er seine DiGA gestaltet und den Patienten informiert, um den Weg zur Nutzung der DiGA durch den Patienten möglichst bruchfrei zu gestalten. Erfahren Sie im vorliegenden Beitrag, wie Sie bei der Verwertung bzw. Vermarktung der DiGA die wichtigsten rechtlichen Klippen umschiffen. Zu den entscheidenden Schnittstellen und Risikobereichen bei der Vermarktung gehören insbesondere der Umgang mit und die Absicherung von Werbeaussagen und –maßnahmen zur DiGA, um den hohen Anforderungen der Rechtsprechung an Werbung im Gesundheitsbereich gerecht zu werden. Zudem sind dabei regulatorische Vorgaben an Medizinprodukte und DiGAs zu beachten.
Seit Inkrafttreten des Digitale-Versorgung-Gesetz (DVG) vom 19. Dezember 2019 können die sog. Digitalen Gesundheitsanwendungen (DiGAs) vom Arzt verordnet werden. Mit Stand vom 19 März 2021 sind bislang elf DiGAs vorläufig oder dauerhaft im DiGA-Verzeichnis aufgenommen worden – ein fortschreitender Prozess, welcher sich in den kommenden Monaten in Anbetracht der attraktiven Möglichkeiten für Anbieter solcher Apps weiter ins Positive entwickeln wird.
I. Von der Verordnung bis zur Abrechnung der DiGA
Im System der gesetzlichen Krankenversicherung (GKV) sind grundsätzlich zwei Wege vorgesehen, über die ein Patient eine DiGA erlangen kann: Über eine Verordnung durch den Arzt oder direkt über die jeweilige Krankenkasse des Patienten. Davon ungeachtet könnten DiGAs auch als Selbstzahler privat erworben werden, wenn der Anbieter der DiGA dies anbietet.
Der Prozess bis zur konkreten Abrechnung einer DiGA im System der gesetzlichen Krankenkasse lässt sich grob in drei Schritte einteilen:
(1) Verordnung durch den Arzt oder Genehmigung durch die GKV, (2) die Verordnungseinlösung/Rezept-Code-Einlösung durch den Patienten und (3) letztlich die Abrechnung selbst (zwischen Anbieter und GKV).
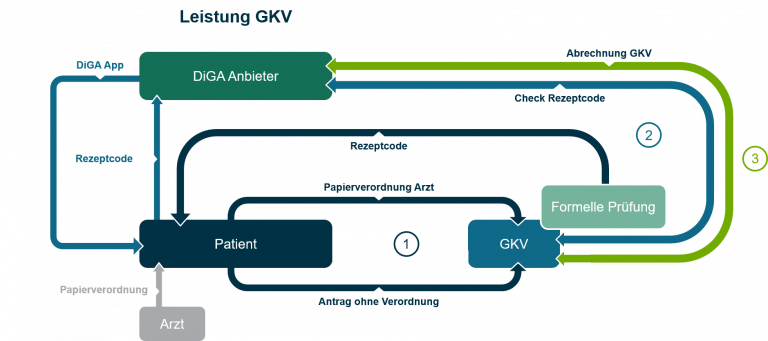
Schritt (1):
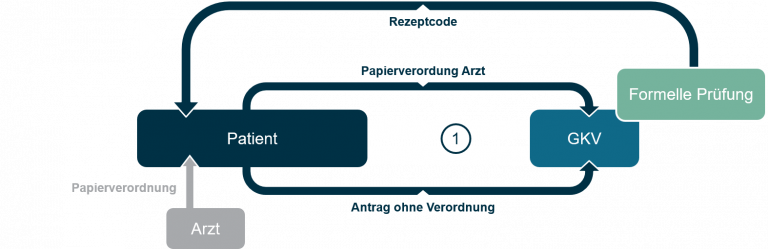
Die Verordnung von digitalen Gesundheitsanwendungen erfolgt (derzeit) noch im herkömmlichen Papiersystem, auf Basis der bereits seit langem bekannten Verordnungsblätter für Arzneimittel. Die Verordnung läuft dann prinzipiell vergleichbar der Verordnung eines Arzneimittels ab. Der Arzt verwendet hierfür das entsprechende Muster-Verordnungsblatt in Papierform und füllt es mit den Daten der zu verordnenden DiGA aus. Für die DiGAs werden durch den Anbieter, ebenso wie dies für Arzneimittel der Fall ist, sogenannte Pharmazentralnummern (PZN) beantragt, über die eine Zuordnung möglich ist. Die PZN ist die für die Verordnung relevante Kennnummer.
Mit seiner Papierverordnung wendet sich der Patient an seine Krankenkasse (je nachdem z.B. per Post, per Krankenkassen-App oder auch per Telefon), die diese formell prüft (Versicherungsstatus, Leistungsanspruch) und dem Patienten im Anschluss einen „Rezept-Code“ zur Verfügung stellt. Mit diesem Code, kann der Patient dann die Gesundheitsanwendung später zur Nutzung „freischalten“ oder aktivieren.
Auch ohne ärztliche Verordnung kann der Patient sich an seine Krankenversicherung wenden und bei dieser die DiGA als Leistung „beantragen“. Erforderlich ist dafür der Nachweis, dass die jeweilige medizinische Indikation, für deren Erkennung, Überwachung, Behandlung oder Linderung die konkrete DiGA zugelassen ist, beim Patienten vorliegt (z.B. durch ärztliches Attest). Genehmigt die Krankenkasse dies, wird sie dem Patienten ebenfalls einen „Rezept-Code“ zur Verfügung stellen.
Schritt (2):
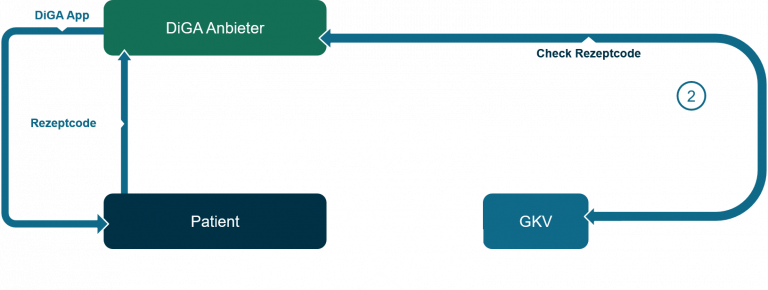
Im Anschluss daran wird der Patient sich mit dem zur Verfügung gestellten „Rezept-Code“ beim Anbieter der DiGA (z.B. in der App) autorisieren und dadurch die DiGA zur Nutzung freischalten.
Wie und wo die DiGA durch den Anbieter angeboten wird (z.B. über die Herstellerwebsite oder über einen App-Store), kann der Anbieter selbst entscheiden. Wichtig ist dabei nur, dass im Rahmen der Installation der App der Rezept-Code abgefragt werden muss, um diesen an die GKV zur Abrechnung zu übermitteln.
Im Hintergrund wird über eine Schnittstelle bei der GKV geprüft, ob der Rezept-Code valide ist. Ist das der Fall, entsteht damit auch der grundsätzliche Vergütungsanspruch des Anbieters gegenüber der GKV.
Schritt (3):

Die Abrechnung erfolgt dann nach § 302 des Fünften Buches Sozialgesetzbuch (SGB V) unter Beachtung der einschlägigen Richtlinien und gegebenenfalls existierenden Verträgen und Preisvereinbarungen (vgl. §§ 134, 139e SGB V). Eventuelle erfolgsbezogene Vergütungsteile werden nach den jeweils vereinbarten Bedingungen abgerechnet, diese blenden wir daher aus.
Zusammengefasst wirkt diese Art der Verordnung in Papierform für eine digitale Gesundheitsanwendung zwar antiquiert, konnte aber gut in das bestehende System integriert werden. Sobald die Verschreibung in Form eines elektronischen Rezepts (E-Rezept) im Einsatz sein wird, ist zu erwarten, dass Verordnungs- und Authorisierungsprozesse weiter automatisiert und digitalisiert werden können. Das Thema sollte laufend beobachtet werden, um der Entwicklung Schritt zu halten und einen möglichst bruchfreien und einfach zugänglichen Versorgungsweg anbieten zu können.
II. Vermarktung der DiGA
Vor dem Hintergrund obiger Ausführungen können zwei relevante Schaltstellen, die bei der Verwertung einer DiGA essentiell sind, identifiziert werden: (1) die Verordnung der DiGA durch den Arzt und (2) die Einlösung der Verordnung durch den Patienten.
Der Unterschied zum klassischen Arzneimittelvertrieb ist dabei eigentlich gar nicht groß, denn auch im Arzneimittelbereich muss zunächst der Arzt eine Verordnung vornehmen, die anschließend der Einlösung durch den Patienten in der Apotheke bedarf. Erforderlich sind also auch eine Handlung des Arztes und des Patienten, um ein Arzneimittel (letztlich) erfolgreich zu vermarkten.
Beide Punkte können grundsätzlich durch Marketingmaßnahmen positiv beeinflusst werden. So wird ohne eine ausreichende Information über die DiGA, z.B. zu deren Anwendungsbereich und Wirkung, ein Arzt möglicherweise gar keine Kenntnis von der DiGA haben und entsprechend auch keine Verordnung vornehmen. Auch ein Patient könnte mit Marketingmaßnahmen adressiert werden, z.B. durch Aufklärungs- und Informationskampagnen. Denn auch der Patient kann sich grundsätzlich, wie oben dargestellt, bei seiner Krankenkasse um eine Versorgung mit der DiGA direkt bemühen (zumindest bei geeigneten DiGAs). Zudem wird ein gut informierter und aufgeklärter Patient sicherlich auch von seiner Verordnung Gebrauch machen und die DiGA erfolgreich(er) für sich nutzen können. Gerade im Kontext der diskutierten und möglicherweise vereinbarten erfolgsabhängigen Vergütungskomponenten ist das ein nicht unwesentlicher Faktor.
Es bestand seit je her ein starkes Interesse daran, durch entsprechendes Marketing gegenüber den beteiligten Kreisen den Vertrieb von Arzneimitteln, Medizinprodukten und Heilmitteln zu fördern. Aufgrund des dabei betroffenen hochwertigen Schutzgutes der Gesundheit sind dem Marketing in diesem Bereich allerdings strenge Grenzen auferlegt. Dies gilt es auch bei der Bewerbung von DiGAs zu beachten.
1.1. Überblick
Die wesentliche Rechtsgrundlage zur Bewertung von Marketingmaßnahmen für Medizinprodukte und Arzneimittel ist das Heilmittelwerbegesetz (HWG). DiGAs sind per Definition ein Medizinprodukt niedriger Risikoklasse. Als Medizinprodukte fallen sie daher grundsätzlich in den Anwendungsbereich des HWG (vgl. § 1 Abs. 1 Nr. 1a HWG). Damit gilt ein recht strenges rechtliches Regime was Werbung für DiGAs betrifft. Nicht jede Regelung des HWG gilt auch für die Medizinprodukte. Anders als bei verschreibungspflichtigen Arzneimitteln (vgl. § 10 Abs. 1 HWG), dürfen Medizinprodukte wie z.B. die DiGA nicht nur gegenüber Fachkreisen, sondern auch gegenüber medizinischen Laien, also insbesondere auch den Patienten, bewor-ben werden. Daneben gelten natürlich die allgemeinen werberechtlichen Vorgaben und Verbote nach dem Gesetz gegen den unlauteren Wettbewerb (UWG), sofern nicht das HWG vorrangig Anwendung findet.
Als Medizinprodukte unterfallen DiGAs der jeweils anwendbaren Medizinprodukteregulatorik, insbesondere dem Medizinproduktegesetz (MPG) und der zukünftig maßgeblichen Medizinprodukteverordnung. Diese rechtlichen Vorgaben strahlen auch auf das Marketing von solchen Produkten und deren Einordnung aus.
Zuletzt gilt es auch die spezifischen rechtlichen Vorgaben an DiGAs beziehungsweise DiGA-Anbieter zu beachten, die sich insbesondere aus der sog. Digitale-Gesundheitsanwendungen-Verordnung (DiGAV) ergeben.
1.2 Rechtliche Rahmenbedingungen beim Marketing von DiGAs
Vorgenannte Regelungen beinhalten eine Vielzahl an Vorgaben, die je nach konkreter Gestaltung der jeweiligen Maßnahme und betroffenen Produkte relevant sein können oder nicht. Die nachfolgende Übersicht ist also keine Checkliste, sondern soll vielmehr helfen, ein Verständnis für wesentliche Eckpunkte und klassische werberechtliche Problemfeldder im DiGA-Kontext zu erhalten. Die Übersicht ist allerdings nicht abschließend und ersetzt nicht die Prüfung im Einzelfall:
(a) Grundsätzlich keine Werbung mit „CE-Prüfung“ oder „CE-Zertifizierung“ bei DiGAs!
Die CE-Kennzeichnung ist notwendige Voraussetzung des Inverkehrbringens eines Medizinproduktes, also auch der DiGA. Die CE-Kennzeichnung ist eine Konformitätserklärung des Herstellers (Eigenerklärung). Durch eine Werbung mit einer „CE-Prüfung“ entsteht aber ganz regelmäßig der (falsche) Eindruck, es gab eine Produktprüfung durch eine unabhängige Stelle.
(b) Irreführende oder unwahre Werbeaussagen sind grundsätzlich zu unterlassen (§ 3 HWG; auch § 4 Abs. 2 MPG)! Es zum Beispiel nicht erlaubt, eine therapeutische Wirkung der DiGA zu bewerben, die diese nicht besitzt oder den falschen Eindruck eines sicheren Erfolgs bei der Anwendung der DiGA zu bewerben. Auch falsche Angaben über die Beschaffenheit der DiGA dürfen nicht gemacht werden.
Achtung: Die Rechtsprechung verfolgt aufgrund der besonderen Schutzwürdigkeit der Gesundheit einen strengen Ansatz! Werbeaussagen für DiGAs mit Gesundheitsbezug sollten daher entsprechend kritisch hinterfragt, sorgfältig geprüft und auch belegt werden können. Bei gesundheitsrelevanten Aussagen sind regelmäßig hohe Standards an deren Nachweis und Transparenz zu erfüllen („gesicherte wissenschaftliche Erkenntnisse“).
Gesundheitsbezogene Werbeaussagen sollten sich immer durch entsprechend belastbare und gesicherte wissenschaftliche Erkenntnisse (insbesondere wissenschaftlichen) Studien belegen lassen und sich innerhalb dieses Rahmens bewegen. Bei der Planung und Durchführung wissenschaftlicher Studien sollte auch darauf geachtet werden, dass etwaig später gewünschte Werbeaussagen wissenschaftlich adressiert werden.
(c) Bei Werbemaßnahmen ist stets die Zielgruppe der Werbung zu beachten! Je nachdem ob Laien oder medizinische Fachkreise (§ 2 HWG: z.B. Ärzte, Apotheker) angesprochen werden, gelten unterschiedliche Regeln und Maßstäbe. Nach § 11 Abs. 1 S. 2 HWG darf gegenüber Laien z.B. nicht geworben werden:
- mit Werbeaussagen, die nahelegen, dass die Gesundheit durch die Nichtverwendung des Arzneimittels beeinträchtigt oder durch die Verwendung verbessert werden könnte,
- durch Werbevorträge, mit denen ein Feilbieten oder eine Entgegennahme von Anschriften verbunden ist,
- mit Veröffentlichungen, deren Werbezweck missverständlich oder nicht deutlich erkennbar ist,
- mit Äußerungen Dritter, insbesondere mit Dank-, Anerkennungs- oder Empfehlungsschreiben, oder mit Hinweisen auf solche Äußerungen, wenn diese in missbräuchlicher, abstoßender oder irreführender Weise erfolgen,
- mit Werbemaßnahmen, die sich ausschließlich oder überwiegend an Kinder unter 14 Jahren richten.
Achtung: Das bedeutet im Umkehrschluss nicht, dass diese Formen der Werbung gegenüber Fachkreisen ohne Weiteres zulässig wären. Da diesen Werbeformen ohnehin bereits gewisse Unlauterkeitsmerkmale innewohnen, ist dies kritisch zu prüfen.
(d) Vorsicht bei Werbung außerhalb der medizinischen Zweckbestimmung der DiGA!
Als Medizinprodukt hat die DiGA eine bestimmte vom Hersteller gegebene Zweckbestimmung. Medizinprodukte dürfen grundsätzlich nur innerhalb ihrer Zweckbestimmung eingesetzt werden. Eine Werbung für eine Anwendung außerhalb dieser Zweckbestimmung birgt zunächst einmal das Risiko werberechtlich angreifbar zu sein, da eine Irreführung der Adressaten möglich, oftmals sogar wahrscheinlich ist.
Zudem gilt: Werbeaussagen können die ursprüngliche Zweckbestimmung der DiGA konkludent verändern beziehungsweise erweitern (vgl. § 3 Nr. 10 MPG). An der neuen, gegebenenfalls unbewusst geänderten Zweckbestimmung muss sich der Anbieter festhalten lassen. Da die App das Verfahren zur Klassifizierung als DiGA beim Bundesinstitut für Arzneimittel und Medizinprodukte mit einer bestimmten Zweckbestimmung durchlaufen hat, drohen deswegen gegebenenfalls auch Konsequenzen (z.B. Anzeigenpflicht wegen geänderter Zweckbestimmung, § 18 DiGAV, § 139e Abs. 6 SGB V).
(e) Grundsätzlich keine Werbung innerhalb der DiGA selbst!
§ 5 Abs. 4 DiGAV schreibt vor, dass die DiGA selbst werbefrei sein muss. Wie der Begriff „Werbung“ nach der DiGAV genau zu verstehen ist, ist noch nicht abschließend geklärt und wird die Praxis zeigen. Die eigene Gestaltung der DiGA und ihre (gegebenenfalls. später ergänzten) Inhalte sollten kritisch darauf geprüft werden, ob darin eine nicht erlaubte Absatzförderung beziehungsweise Werbung gesehen werden könnte (z.B. Rabattangebote, In-App-Kaufmöglichkeiten; Bannerwerbung usw.).
(f) Große Vorsicht bei Geschenken und anderen Zuwendungen!
Im Zusammenhang mit der Bewerbung und dem Absatz von Medizinprodukten (also auch der DiGA) sind Zuwendungen wie beispielsweise Werbegeschenke (z.B. Post-Its, Gutscheine etc.) (sog. Wertreklame) nur innerhalb der Grenzen von § 7 HWG zulässig. Insbesondere dürfen diese in der Regel nur einen geringen Wert haben und müssen bei Fachkreisen zur Verwendung in deren Praxis bestimmt sein. Für Imagewerbung (kein Produktbezug) gilt diese strenge Grenze nicht. Das sollte allerdings kritisch geprüft werden.
Achtung: Bei Verstößen gegen dieses Zuwendungsverbot drohen gegebenenfalls auch strafrechtliche Konsequenzen (Bestechung/Bestechlichkeit).
(g) Allgemeine Anforderungen an Werbung beachten!
Wie bereits eingangs erwähnt, sollten auch die allgemeinen Vorgaben an Werbung beachtet werden. Typische Problemfelder ergeben sich beispielsweise beim Einsatz von Influencern (Verantwortung für Werbeaussagen), Suchmaschinenoptimierung/Tracking (AdWords, Datenschutz etc.) und E-Mail-Marketing (Einwilligung in E-Mail Werbung).
1.3 Konsequenzen bei Verstößen gegen das Heilmittelwerberecht und Wettbewerbsrecht
Werberechtliche Verstöße können insbesondere von Konkurrenten und Wettbewerbsverbänden verfolgt werden. Bei erfolgreicher Geltendmachung müsste die angegriffene Verhaltensweise zukünftig unterlassen werden.
Typischerweise erfolgt zunächst eine Abmahnung mit der Aufforderung zur Abgabe einer strafbewehrten Unterlassungsverpflichtungserklärung. Als nächste Eskalationsstufe wäre die Beantragung einer einstweiligen Verfügung beim zuständigen Gericht, die gegebenenfalls sehr kurzfristig (innerhalb weniger Stunden oder Tage) zu einer vorläufigen gerichtlichen Entscheidung führt. Eine abschließende gerichtliche Klärung kann im Klagewege verfolgt werden.
Verstöße gegen das HWG können im Übrigen auch als Straftat oder Ordnungswidrigkeit verfolgt werden (vgl. §§ 14, 15 HWG).





